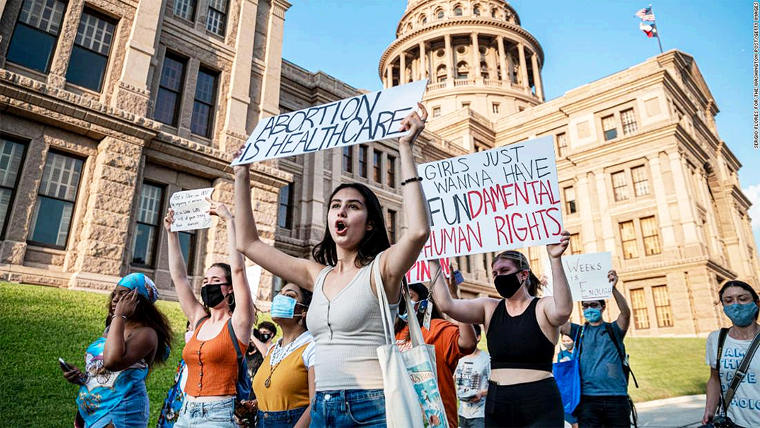El juez de la Corte Suprema Samuel Alito volvió a extender este miércoles el acceso a la píldora para abortar en Estados Unidos, mientras el alto tribunal evalúa el caso, al suspender temporalmente el fallo de un tribunal inferior que ordenó restricciones en el acceso al medicamento.
La medida busca dar a los jueces más tiempo para considerar el tema, aunque no anticipa cómo será su fallo en el caso.
En una orden similar la semana pasada, Alito había dicho que la Corte Suprema tendría un fallo a las 11:59 p.m., hora de Miami, este miércoles. La nueva orden, llamada “suspensión administrativa”, traslada esa fecha límite al viernes 21 de abril.
Alito escribió la orden porque tiene jurisdicción sobre el tribunal inferior que falló en la disputa.
“La orden de hoy no revela nada sobre cómo fallará la Corte (Suprema) en pleno, aparte de que es probable que haya algún tipo de escrito, ya sea por parte de la mayoría o de los jueces que podrían estar escribiendo concurrencias o disidencias por separado”, explicó Steve Vladeck, analista de CNN sobre la Corte Suprema y profesor de la Facultad de Derecho de la Universidad de Texas. “Pero es imposible saber cómo será ese fallo. Todo lo que sabemos con certeza es que tendremos más información al final de la noche del viernes”, añadió.
Este es el caso relacionado con el aborto más importante que a la Corte Suprema desde que los jueces anularon la protección al derecho al aborto de Roe vs. Wade en 2022, lo que provocó que los estados conservadores de todo el país prohibieran o restringieran severamente el procedimiento. La manera en que se resuelva en última instancia la disputa sobre el aborto con medicamentos podría dificultar el acceso de las mujeres a este, incluso en los estados que aún lo permiten.
Lo que está en juego es el alcance de la autoridad de la Administración de Alimentos y Medicamento de EE.UU. (FDA, por sus siglas en inglés) para regular el medicamento mifepristona, que la comunidad médica ha considerado seguro y eficaz. La mifepristona ha sido utilizada por millones de mujeres en todo el país en las más de dos décadas que lleva en el mercado.
La batalla legal comenzó en noviembre pasado cuando un grupo que representa a médicos que se oponen al aborto presentó una demanda con el argumento de que la FDA no había hecho lo suficiente para garantizar la seguridad del medicamento unas dos décadas antes.
El juez del Tribunal de Distrito de EE.UU. Matthew Kacsmaryk, designado por Trump, emitió un fallo amplio el 7 de abril que bloqueó la aprobación del medicamento, así como los cambios que la FDA realizó en los años siguientes para que fuera más accesible. Sin embargo, retrasó siete días la fecha de vigencia de su fallo para dar tiempo a una apelación.
Rechazando el consenso de la comunidad médica, Kacsmaryk planteó dudas sobre la seguridad del medicamento, incluyendo en su opinión la jerga que suelen utilizar los opositores al aborto. Calificó a los médicos que realizan el procedimiento de “abortistas” y explicó que rechazaría el término “feto” a favor del más incendiario “humano por nacer”. En lugar de referirse al procedimiento como un “aborto con medicamentos”, insistió en llamarlo “aborto químico”.
La FDA, sostuvo Kacsmaryk en un momento, “consintió en sus legítimas preocupaciones de seguridad, en violación de su deber legal, en base a un razonamiento y estudios claramente erróneos que no respaldaron sus conclusiones”.
Las principales asociaciones médicas han desmentido las afirmaciones del juez sobre los peligros del fármaco, y se ha demostrado que la mifepristona es más segura que medicamentos comunes como la penicilina y el Viagra.
En una cuestión clave, el juez insistió en que los demandantes ––médicos que no utilizan ni prescriben el fármaco–– tenían derecho legal a comparecer ante el tribunal para exponer su caso, ya que sostienen que el uso del medicamento podría «saturar» el sistema de salud.
Asombrados por la amplitud de la decisión, el Gobierno de Biden y Danco, fabricante del medicamento, presentaron una demanda ante el Tribunal de Apelaciones del 5º Circuito de EE.UU. El tribunal de apelaciones finalmente dejó en pie la aprobación del fármaco por parte del gobierno, pero coincidió con Kacsmaryk en que el acceso podía limitarse.
Un panel dividido de tres jueces ordenó volver al régimen más estricto del fármaco de la FDA, anterior a 2016, que impide el envío por correo de la píldora a los pacientes que la obtuvieron a través de consultas de telemedicina, o visitas virtuales con sus proveedores, en lugar de acudir en persona a una clínica u hospital para obtener el medicamento. También revoca de hecho la aprobación de 2019 de la versión genérica del medicamento. Las restricciones también afectan a las instrucciones del fármaco, acortando la ventana de obtención de la píldora a siete semanas de embarazo, en lugar de diez.
Sin embargo, es posible que, incluso con la sentencia en vigor, algunos proveedores se salgan de la norma y sigan recetando la mifepristona hasta las 10 semanas.
El 5º Circuito afirmó que las normas de la FDA para el fármaco creaban «un régimen excesivamente inusual» y que los médicos antiabortistas tenían derecho a demandar por ello porque «necesariamente se verían perjudicados por las consecuencias» de la decisión de la FDA de «apartar a los médicos de la prescripción y administración de mifepristona».
El tribunal de apelaciones afirmó que las reglas de prescripción probablemente impedían a los demandantes impugnar la aprobación de 2000, pero que era probable que tuvieran éxito en sus demandas contra las medidas más recientes de la FDA para ajustar las normas relacionadas con el fármaco.
El tribunal acusó a la FDA de tener un «enfoque ignorar la realidad» respecto al fármaco que era «profundamente preocupante».
La procuradora general, Elizabeth Prelogar, instó a los jueces a intervenir en los documentos legales citando «órdenes sin precedentes de tribunales inferiores que revocan el juicio científico de la FDA y desencadenando un caos normativo al suspender las condiciones de uso existentes aprobadas por la FDA para la mifepristona»