Tres personas que habían quedado parapléjicas tras accidentes de moto han conseguido volver a ponerse en pie y dar unos pasos. Ha sido gracias a una intervención quirúrgica para implantar 16 electrodos directamente sobre su médula espinal. Los tres participantes habían perdido toda capacidad de movimiento en sus extremidades inferiores y el tronco debido al corte completo de la médula. “Un día después de empezar a practicar vi que mis piernas se movían otra vez; fue una emoción muy intensa”, ha explicado Michel Rocatti, uno de los tres pacientes, en una rueda de prensa.
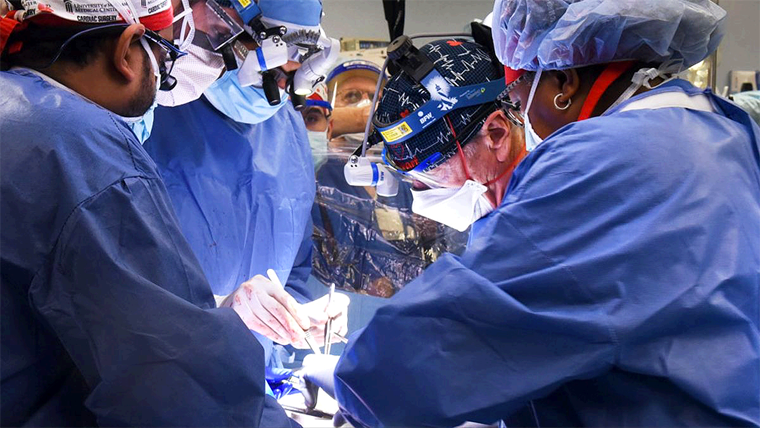
El neurocientífico Grégoire Courtine, de la Escuela Politécnica Federal de Lausana (Suiza), y la neurocirujana Jocelyne Bloch, del hospital universitario de la misma ciudad, dirigen el equipo científico responsable de este logro. En una operación de cuatro horas, se han implantado los electrodos que emiten pulsos eléctricos sincronizados que imitan las señales que circulan a lo largo de la médula espinal, y esta vincula el cerebro con los miembros inferiores. A su vez, los electrodos van conectados a un ordenador con un sistema de inteligencia artificial que reproduce los impulsos necesarios para caminar, montar en una bicicleta especial o remar en una piragua (en el caso de un paciente sin movilidad en el bajo tórax). Estas son tres de las actividades que han conseguido realizar los participantes en este estudio, cuyos detalles se publican este lunes en Nature Medicine.
El equipo de Courtine lleva años intentando devolver la movilidad a personas que quedaron parapléjicas por accidentes. En 2014, probó su sistema con ratones a los que antes se les había separado la médula y dos años después hizo lo mismo con monos. En otoño de 2018, el equipo suizo presentó las innovaciones con David Mzee, un joven que quedó parapléjico a los 20 años. Gracias a este tipo de estimulación epidural y con ayuda de un andador, Mzee consiguió volver a caminar.
El nuevo trabajo publicado este lunes presenta una gran novedad: por primera vez los electrodos y los largos cables que llevan conectados han sido fabricados específicamente para este ensayo y teniendo en cuenta las lesiones particulares de cada participante. “Hasta ahora todos los implantes de este tipo reutilizaban electrodos originalmente diseñados para tratar el dolor”, explica Courtine. “Diseñar por primera vez una tecnología específica para este nuevo uso nos permite sincronizar mejor la estimulación con el momento del movimiento imitando las señales reales que envía el cerebro al andar, por ejemplo”, detalla el científico.
En esta ocasión se ha logrado estimular no solo los nervios que mueven las piernas, sino también los músculos del abdomen y espalda baja. Los participantes pudieron volver a estar de pie inmediatamente después de la operación y dieron sus primeros pasos, al principio suspendidos con un arnés. Afinar los movimientos llevó tiempo de entrenamiento, pero finalmente, al cabo de unos cuatro o cinco meses, Rocatti, por ejemplo, pudo andar por la calle y salir a tomar algo a un bar caminando con un andador desde el que puede controlar la intensidad y cadencia de los impulsos eléctricos. “Cuando uso el aparato me encuentro mejor, me siento más fuerte y los dolores asociados a la silla de ruedas desaparecen”, ha explicado el paciente.
Lesiones que ya no son irreversibles
El avance se suma a los conseguidos por dos equipos de EE UU que usan sistemas de estimulación eléctrica continua y que también han permitido caminar a algunos pacientes después de haber quedado parapléjicos por accidentes. La idea más importante detrás de estos trabajos es que algunas lesiones medulares ya no deben considerarse irreversibles.
El equipo suizo ha tratado ya a nueve personas en lo que por ahora es solo una intervención experimental para un número muy reducido de lesionados. Pero Courtine explica que su equipo espera comenzar los primeros ensayos clínicos con más pacientes en 2023, en parte a través de Onward Medical, la empresa que ha creado junto a Bloch para la futura comercialización de esta tecnología. Los ensayos llevarán aún unos cuantos años de trabajo. “Vamos todo lo rápido que podemos”, asegura el neurocientífico.
“Estos nuevos resultados son espectaculares”, opina Filipe Barroso, investigador del grupo de neurorrehabilitación del Instituto Cajal (CSIC), en Madrid. Indica que lo más destacado es que se trata de pacientes con una lesión medular completa, frente a los anteriores de 2018, que sí conservaban algo de función residual. “Además, los resultados aparecen en un día, lo que se explica por la colocación óptima de los electrodos”, resalta.
Barroso trabaja sistemas de estimulación menos invasivos que pueden situarse sobre la piel o incluso dentro de los músculos. En este último caso, su equipo demostró el verano pasado que unos electrodos consiguen una reducción “espectacular” de los temblores en pacientes con trastornos del sistema nervioso.
Diego Serrano, investigador de la Universidad de Castilla-La Mancha, visitó el laboratorio de Courtine y Bloch en 2018. “Es evidente que están afinando su técnica para conseguir un movimiento lo más natural posible”, resalta. “Los electrodos se implantan ahora con una precisión milimétrica, de hecho, el colocarlo uno o dos milímetros más arriba o abajo tiene unos resultados enormes”, destaca el experto, que ve “complicado” ampliar el alcance de esta tecnología a un mayor número de pacientes. “Es difícil porque cada lesión de médula es muy específica, prácticamente única, por lo que necesitas desarrollar un tratamiento específico para cada uno”, añade.